Aan de hand van een aantal veel gestelde vragen geven we in deze bijdrage commentaar op de vele controverses die leven in de ‘oorlog rondom de zoutaanbevelingen’ (Voedingsgeneeskunde jg. 18 nr. 2). We hebben geprobeerd de onderwerpen objectief te benaderen. Het is onze hoop dat deze inbreng bijdraagt aan de totstandkoming van een zoutaanbeveling die ons allen ten goede komt.
Wat zijn de gevaren van een te hoge zout (natrium) inname? Te boek staan: hoge bloeddruk, hart- en vaatziekte (myocardinfarct, beroerte, hartfalen), nierziektes, nierstenen, osteoporose en maagkanker. Hoge bloeddruk is geen ziekte maar een symptoom. Dit symptoom is geassocieerd met hart- en vaat-, en nierziekte en komt veelvuldig voor als onderdeel van het metabool syndroom, een combinatie van overgewicht/obesitas, hypertensie en een gestoorde glucose- en vetstofwisseling.1 Vaak wordt gesteld dat een hoge zoutinname hoge bloeddruk veroorzaakt, hoge bloeddruk een bekende risicofactor is voor hart- en vaatziekte en nierziekte, en dat de zoutinname dus moet worden verminderd.1a,1b Zoals zal worden beargumenteerd, bestaat voor deze, op zich logisch klinkende, ‘stepping stone’ in onze ogen geen bewijs voor werkelijk gezonde mensen.
Hoe groot is het risico?
De WHO stelt dat in de wereld per jaar 2,5 miljoen doden kunnen worden voorkómen als de zoutinname wordt gereduceerd naar de WHO-aanbeveling van maximaal 5 gram per dag.1c Zulke berekeningen zijn ook voor Nederland gemaakt. Voor een periode van 20 jaar is de uitkomst: 16,5% minder beroertes, 10,8% minder ischemische hartziektes en 46.100 (1,5%) uitgestelde overlijdens.2 De gebruikte gegevens in dit soort ‘ecologisch’ onderzoek komen louter uit observationele studies. Normaliter worden ze in de voedingswetenschap niet geaccepteerd als een bewijs voor een causaal verband. Zo werden zulke gegevens bij gebrek aan bewijskracht niet meegenomen in de ontwikkeling van de Nederlandse ‘Richtlijnen Goede Voeding 2015’.3 Echter, zonder terughoudendheid worden deze doemscenario’s over het publiek uitgestort.
Wat zijn de toetsbare feiten? Op grond van 8 gerandomiseerde studies (RCTs) van langer dan 6 maanden met in totaal 7.284 deelnemers kwam de invloedrijke Cochrane Database in 2014 tot de conclusie dat het verlagen van de zoutinname de kans op overlijden vanwege alle oorzaken en cardiovasculaire oorzaken niet verlaagt. Er was een zwak-significante verlaging van de cardiovasculaire morbiditeit.4 Ook belangrijk is te weten dat de beoordeelde studies werden uitgevoerd in hypertensieve (5 studies) en pre-hypertensieve obese (3 studies) personen.5 Er zijn geen RCTs met harde eindpunten waarin gezonde personen hun zoutinname verlaagden naar de huidige aanbevelingen.1a,5,5a
Ten minste 6 observationele studies laten een U-curve (of J- curve) zien voor de relatie tussen risico en natriuminname. Slechts één toont een louter lineair verband.6 In studies die een U-curve tonen waren natriuminnames onder 2.645 mg/dag en boven 4.945 mg/dag geassocieerd met een hogere mortaliteit.5,5a Merk op dat alle huidige aanbevelingen (zie beneden) beneden de 2.645 mg natrium per dag liggen, dus in het ‘risicogebied’ van observationele studies. Echter, vooral op het hogere risico bij een lage zoutinname is het één en ander af te dingen. Onder andere vanwege de potentiële inclusie van deelnemers met hoog-risicoziektes. Mogelijk eten die minder, of is aan hen een zoutarme voeding voorgeschreven.1a In één van de studies die een J-curve liet zien, was het risico van een hogere natriuminname groter voor personen met hypertensie, maar niet voor mensen met een normale bloeddruk. Het laagste risico op hart- en vaatincidenten en overlijden lag in deze studie rond een inname van 4.600 mg natrium per dag.7 Wij wijzen er nogmaals op dat het hier observationele studies betreft, maar dat het om grote aantallen mensen gaat.
Wat zijn de huidige aanbevelingen voor de zout (natrium) inname?
Er zijn relatief kleine verschillen in de aanbevelingen van de verschillende instanties. Voor volwassenen variëren ze tussen maximaal 5 (WHO) en 6 (Voedingscentrum) gram zout per dag. Dat komt overeen met 2-2,4 gram natrium.1a,8-11 De aanbevelingen zijn gebaseerd op een ‘balansstudie’. Negen (!) volwassenen hadden bij een inname van 1,5 gram natrium/dag een even grote uitscheiding via de urine, feces en transpiratievocht;11 ze waren dus in (een schijnbare, zie beneden) natriumbalans. Het is ons inziens een gedachtenfout om ervan uit te gaan dat onze fysiologie is gebaseerd op een minimumbehoefte of een balans die ernaar streeft om ‘wat binnen komt er ook direct weer uit moet’.
De voorouderlijke natriuminname door jager-verzamelaars wordt geschat op minder dan 1 gram per dag.12 Deze schatting hield echter geen rekening met onze afkomst uit het land-waterecosysteem aan de Zuid-Afrikaanse kust13,14 en het hoge zoutgehalte van de meren van de Afrikaanse ‘Rift Valley’.15,16 Er zijn goede aanwijzingen dat Homo sapiens daar vandaan komt.13,14,17-19 De Yanomami-indianen in het Braziliaans-Venezolaanse Amazone-oerwoud hebben een natriuminname van ongeveer 23 mg per dag en een bloeddruk van 95/61 mm Hg.12,20 In tegenstelling tot wat in westerse landen wordt gezien, stijgt hun bloeddruk niet met de leeftijd.21,22 Ook hebben ze een zeer hoge kaliuminname, een lage body mass index (BMI), gebruiken ze geen alcohol, hebben ze een hoog niveau van fysieke activiteit en ondergaan ze weinig psychosociale stress.21 Echter, hun renine- en aldosteronspiegels zijn sterk verhoogd.20 Of hun hoog-efficiënte natriumhuishouding gebruikelijk was gedurende een groot deel van de evolutie,20 is de vraag. Wat deze gegevens zeker laten zien is dat de mens zich blijkbaar kan aanpassen aan een extreem lage natriuminname. Maar dat verheft de Yanomami nog niet tot norm.
In de literatuur wordt herhaaldelijk melding gemaakt, onder andere door de WHO,23 dat de mens niet meer dan zo’n 200-500 mg natrium nodig heeft per dag.24-27 Deze bewering laat zich traceren naar een artikel uit 1960 van Dahl en medewerkers.28 Daarin stellen de auteurs28 dat ze in hun 12 jaar bestudering van dit onderwerp geen adrenocorticale disfunctie hebben waargenomen in meer dan 100 personen die een voeding aten met 100-150 mg natrium per dag (250-375 mg zout) voor een periode van 3 maanden tot bijna 5 jaar.24 En dat een metabole balans met gemak kan worden behouden bij een dagelijkse zoutinname van 500-1.000 mg natrium, en zelfs 100-375 mg.24 Zoals ze echter ook schreven konden ze niet uitsluiten dat een hoge zoutinname gunstig is.28 Die opmerking is in de loop der jaren verloren geraakt.
Hoeveel zout eet men in de wereld en Nederland?
Vijfennegentig procent van de volwassen wereldbevolking eet tussen de 6,6 en 12,2 gram zout per dag.5 Gemiddeld 9,3 gram.29 Conform de Amerikaanse aanbevelingen dienen 6-7 miljard (78-91%) van de 7,7 miljard wereldburgers hun zoutgebruik terug te brengen naar 5,75 gram/dag.5 Er moeten dus wel sterke argumenten zijn om nagenoeg iedereen aan te bevelen om het zoutgebruik drastisch te reduceren. In Nederland eten volwassenen gemiddeld 8,7 gram zout/dag (9,9 g mannen, 7,5 g vrouwen). Vijfentachtig procent van de volwassenen eet meer zout dan het in Nederland aanbevolen maximum van 6 gram/dag.30
Hoe effectief zijn zoutreductie-programma’s?
Van de 10 evalueerbare initiatieven lieten vijf een verlaging van de zoutinname zien die lag tussen de 0,35 tot 1,15 gram per dag. Daarentegen vertoonden drie initiatieven geen verschil en in twee gevallen steeg de zoutinname met respectievelijk 0,80 en 1,66 gram/dag.31 In Japan en Finland daalde de zoutinname. Ook daalde daar de bloeddruk en de sterfte aan maagkanker (Japan) en beroerte. Wat men er meestal niet bij vertelt, is dat daar de dagelijkse zoutinnames respectievelijk 18 en 14 gram bedroegen en dat de inname daalde naar wat de rest van de wereld gemiddeld aan zout eet of nog steeds daarboven.32 Er is grote overeenstemming over de stelling dat een extreme zoutinname ongunstig is, met name voor personen met hypertensie.1a De kwestie is echter: waar begint ‘extreem’?
Ook het succesverhaal van de UK ligt genuanceerd. Daar ging de inname van gemiddeld 9,5 naar 8,1 gram zout per dag.33 Parallel daaraan daalde de bloeddruk en sterfte aan beroerte en hartziekte.32 Een verdere daling van de zoutinname is onwaarschijnlijk. Ons lichaam laat zich niet door de wetenschap vertellen wat we aan natrium nodig hebben of lekker vinden. Zoutbehoefte (‘natriumhonger’) en zoutconsumptie (‘spontane trek in natrium’) zijn aparte entiteiten.34 Veelvuldig wordt de conclusie van Dahl herhaald.20 Die stelde dat in geciviliseerde gemeenschappen de eetlust voor zout niet hetzelfde is als de hoeveelheid zout die we nodig hebben.35
Verlaagt minder zoutgebruik de bloeddruk?
Ja. Er is geen zinnige wetenschapper die de harde onderbouwing daarvoor1a,36 zal ontkennen. In 2020 evalueerde de invloedrijke Cochrane Database in totaal 195 RCTs. Gekeken werd naar de bloeddrukverandering als de zoutinname zou dalen van 11,9 gram/dag (4.667 mg natrium) naar 3,8 gram/dag (1.494 mg natrium).37 Twaalf gram zout komt overeen met de 95e percentiel van wat de wereldbevolking eet.5 De inname van 1.500 mg natrium/dag wordt door de American Heart Association als ideaal beschouwd.9 De uitkomst was dat in personen met een normale bloeddruk de gemiddelde systolische bloeddruk met niet meer dan 1,14 mm Hg daalde. De diastolische bloeddruk veranderde niet. Echter, in personen met hypertensie daalden de systolische en de diastolische bloeddrukken met respectievelijk 5,71 en 2,87 mm Hg.37
Dat een vermindering van de zoutinname de bloeddruk doet dalen, is niet het punt. Waar het om gaat is met hoeveel de bloeddruk daalt, of schijnbaar gezonde personen homogeen zijn in hun gevoeligheid voor zout, of de huidige aanbevelingen moeten gelden voor alleen hypertensieven, dan wel de gehele bevolking, en of de aanbeveling moet zijn zoals momenteel (≤2.300 mg natrium per dag), zoals men gemiddeld eet (3.600 mg natrium/dag) of misschien wel hoger (bv. <5.000 mg natrium/dag).1a Bovenal gaat het om ziekte en daarvoor bestaat, zoals boven beschreven, formeel geen bewijs uit RCTs, ook al niet uit prospectief onderzoek en al helemaal niet voor werkelijk gezonde personen.
Regelmatig is te horen dat een 1-2 mm Hg bloeddrukdaling op een wereldbevolking van 7,7 miljard mensen wel degelijk een gezondheidswinst oplevert. Die bewering gaat uit van de scenario’s die gebaseerd zijn op de reeds genoemde observationele studies en die normaliter dus niet worden geaccepteerd als bewijs.3,37a Bovendien wordt een aanhoudende verlaging van 2-3 mm Hg noodzakelijk geacht voor een belangrijke daling van het risico op hart/vaatziekte.37b Voor zover bekend zijn er geen publicaties waarbij, in het meest zwarte scenario, de winst in mortaliteit en morbiditeit wordt gewogen tegen het genot van eten van een beetje meer zout door gezonde personen. Het gevoel komt op dat je mogelijk langer leeft, maar dat het zeker langer gaat lijken.
Hoe reageert het lichaam op een verlaging van de zoutinname?
In de 2020 Cochrane Database van 195 RCTs werd daarnaar gekeken.37 Een lagere natriuminname veroorzaakt een stijging van de hormonen renine, aldosteron, noradrenaline en adrenaline. Ook stijgt het cholesterol en de triglyceriden. Deze veranderingen traden vooral op bij de mensen met een normale bloeddruk.37
Deze intussen goed gedocumenteerde veranderingen in hormonen en lipiden worden door de voorstanders van zoutbeperking weggewoven. Het argument is dat ze bij de aanbevolen natriuminnames meevallen in de zin van hun invloed op cardiovasculaire incidenten en mortaliteit.1a De hormoon- en lipideveranderingen wijzen echter op een stressreactie. Deze wordt georkestreerd door het sympathisch zenuwstelsel en het renine-angiotensine-aldosteron-systeem (RAAS). Het is een reactie op een gevaar van uitdrogen. Uitdrogen vanwege maag-darminfecties was in het verleden een belangrijke doodsoorzaak en is dat nog steeds in vele ontwikkelingslanden. De potentiële kwetsbaarheid van mensen die een kritische inname hebben van zout, is voor zover wij weten niet onderzocht. Zo vormt het hogere natrium in onze huid een microbiële barrière37c en wordt natrium, waarschijnlijk als antimicrobieel middel, naar een infectieplaats gedirigeerd.37d De plaats van zout in het immuunsysteem staat nog in de kinderschoenen.
Waarom verhoogt de inname van zout de bloeddruk?
In tekstboeken staat dat zout water vasthoudt. Als het niet wordt uitgescheiden gaat de bloeddruk dus omhoog. Als rekenvoorbeeld: een normale plasma natriumconcentratie bedraagt 140-150 mmol/L. Als het lichaamsnatrium met 140-150 mmol (3.200-3.400 mg) stijgt dan houdt het lichaam dus 1 liter water vast.
Is dit waar?
Nee, althans niet voor gezonde mensen voor wie de aanbevelingen zijn bedoeld. We kunnen natrium opslaan in de huid en spieren op een osmotisch neutrale manier. Ook kan natrium worden gebonden aan de glycocalyx van het endotheel.38-45 De glycocalyx is een koolhydraatrijke slijmlaag die tegen de celmembraan van endotheelcellen aanligt, onder andere voor bescherming. In tegenstelling tot de heersende gedachte wordt, na de consumptie van een natriumoverschot, dus niet navenant meer water vastgehouden om onze osmolariteit constant te houden. En gaat de bloeddruk dus ook niet omhoog.40 Uiteraard zijn daaraan ook grenzen: ieder systeem kan worden overladen. Patiënten met refractaire hypertensie hebben hogere natriumgehaltes in hun weefsels dan normotensieve controles. Er is een relatie met de natriumopslagcapaciteit en die is responsief op diuretica en dialyse.39 Bij patiënten met hartfalen is gevonden dat een verhoogd lichaamsnatrium kan optreden met en zonder perifeer oedeem.44 Zoutsensitieve personen hebben een lagere capaciteit om natrium te binden aan het endotheel.43 Deze belangrijke nieuwe gegevens zijn niet meegenomen in de momenteel geldende aanbevelingen voor zout.
Wat gebeurt er nog meer als je de natriuminname verlaagt?
Natrium is na calcium en fosfaat het 3e belangrijkste mineraal in ons bot. Vijfendertig procent van ons lichaamsnatrium bevindt zich in onze botten.46 In een Japanse studie bleek dat bij een dagelijkse matige47 of relatief zware48 fysieke inspanning, en een dagelijkse inname van 2.300 mg natrium (6 gram zout), het lichaam in natriumbalans verkeert. Er was echter een negatieve calcium- en magnesiumbalans. Waarschijnlijk werd natrium uit het bot gemobiliseerd en ging daarbij het ge-comobiliseerde calcium en magnesium via de urine47 en het transpiratievocht48 verloren. Het gaat dus om een schijnbare natriumbalans, die ook nog eens ten koste gaat van andere mineralen in het bot. Deze studies worden zo goed als genegeerd. Volgens Google zijn ze slechts 3747 en 748 keer aangehaald. Bij het opstellen van hun aanbevelingen concludeerde het Amerikaanse Institute of Medicine (IOM) dat gezonde personen na acclimatisering een natriumbalans kunnen bereiken bij een combinatie van een lage natriuminname en extreme temperatuur.11 Er werd geen rekening gehouden met een, toen nog niet bekende, potentiële mobilisering van natrium, en daarmee andere mineralen, uit het bot. Mineralen kunnen niet los worden gezien van elkaar (zie ook beneden).
Ten slotte werd in een meta-analyse van 63 RCTs vastgesteld dat natriumrestrictie de bloeddruk met 2,5% verlaagt, maar daarentegen de hartslag met 2,4% verhoogt. Er lijkt dus een compensatie op te treden. Of een hogere hartslag gunstig is, mag worden betwijfeld.49
Kunnen gezonde nieren onze ‘hoge’ natriuminname eigenlijk wel aan?
Met gemak. Gezonde nieren scheiden 95-98% van de natriuminname weer uit. De rest verdwijnt via het maag-darmkanaal en de huid, en, naar we nu weten, kan een deel worden opgeslagen. Normaliter wordt 99% van wat de nieren aan natrium filtreren teruggeresorbeerd. Met een glomulaire filtratiesnelheid (GFR) van 120 mL/min en een plasma-natriumconcentratie van 140 mmol/L laat zich op eenvoudige wijze berekenen dat als de nieren die gefilterde natrium niet zouden terugresorberen een normale dagdosering van 9 gram zout (3.600 mg natrium) in 9,3 minuten via de urine verdwijnt. De natriuminname is dus niet het probleem. Als één orgaan de schuld moet krijgen dan zijn het onze nieren. Sinds het leven op aarde de oceaan begon te verlaten, zo’n 541-485 miljoen jaar geleden (Cambrische explosie), werd het verkrijgen van natrium een probleem. Er ontwikkelde zich een uitermate efficiënt systeem dat natrium vasthoudt. Dat systeem is beter bekend als het RAAS.50-52 Onze nieren zijn erop gebouwd om natrium vast te houden en kalium uit te scheiden.
Hoe zit het met de interactie van natrium met andere elektrolyten?
De meeste studies kijken alleen naar natrium, of alleen naar kalium, magnesium, etc. Je kunt natrium echter niet los zien van kalium. Ook niet los van de calcium/magnesium-verhouding en ook al niet van ons zuur-base-evenwicht. Zo komt kalium in onze natuurlijke voeding samen voor met magnesium en bicarbonaat.11 Onbewerkte voeding bestaat vooral uit intacte cellen van planten en dieren, en kalium en magnesium zijn typische intracellulaire elementen. Het extracellulaire compartiment in onze natuurlijke voeding is veel kleiner en dat bevat relatief veel natrium, chloride en calcium.53 Bij de (ultra)bewerking van voeding raken veel mineralen en vitamines verloren. De industrie voegt er vervolgens (veel) natrium aan toe. Gevolg is onder andere een hoge natrium/kalium-verhouding in wat we tegenwoordig eten.54
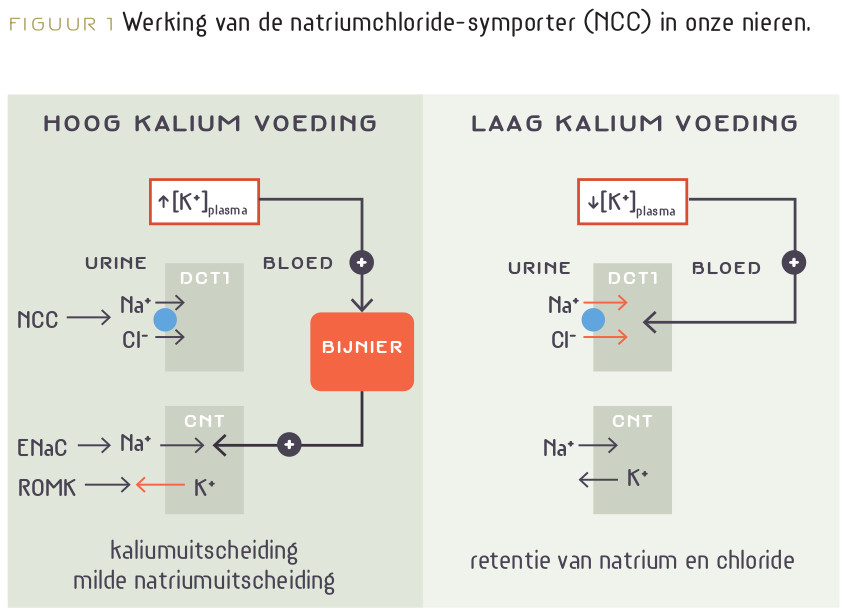
Natrium en kalium fungeren meestal als antagonisten. Bij een (zeer onnatuurlijke!) lage kaliuminname gaan de nieren meer natrium vasthouden. Het onderliggende mechanisme is goed bekend. De natriumchloride-symporter (NCC) speelt daarbij een hoofdrol (figuur 1).55-59 Het lijkt alsof het voor het lichaam gunstiger is om een lichte natrium/kalium-disbalans te accepteren dan een daling van de osmotische druk en uitdroging te riskeren. Omgekeerd wordt de natriumuitscheiding bevorderd als de kaliuminname stijgt.11 Een lage kaliuminname versterkt dus het bloeddrukverhogende effect van een hoge natriuminname en ook het daaraan geassocieerde hogere risico op hart- en vaatziekten. Omgekeerd kan kaliumsuppletie bij een hoge natriuminname de bloeddruk doen dalen en het risico op hart- en vaatziekte en nierschade verlagen. Een hogere kaliuminname kan een gevoeligheid voor natrium zelfs tenietdoen, in zowel normotensieven als hypertensieven.55
Ook calcium en magnesium fungeren doorgaans als elkaars antagonisten. De calcium/magnesium-ratio in onze voeding is in de tijd gestegen en is gelinkt aan diabetes, metabool syndroom, osteoporose, hypertensie en andere inflammatie-gerelateerde ziektes. Een hogere calciuminname uit de voeding is mogelijk ontstaan vanwege de selectie van bepaalde voedingsmiddelen, een hoger calciumgehalte, of beide.60 Daarenboven is calcium om verkeerde redenen het meest populaire voedingssupplement. Osteoporose is geen botontkalking, maar verlies van botmassa, dus ook verlies van eiwitmatrix. Het mineraalgehalte kan je beïnvloeden, maar eenmaal verloren eiwitmatrix komt nooit meer terug.
Chloride en bicarbonaat zijn eveneens antagonisten. Met natrium voegt de industrie een navenante hoeveelheid chloride toe. Hierdoor stijgt de chloride/bicarbonaat-ratio.11 Bicarbonaat (base) wordt in ons lichaam gemaakt uit voorlopers die vooral in groente en fruit zijn te vinden. Daarvan wordt meestal onvoldoende gegeten. Het bicarbonaatevenwicht staat centraal in onze zuur-basebalans. De verhoogde chloride/bicarbonaat-ratio is gelinkt aan het ontstaan van een chronische toestand van laaggradige (gecompenseerde) metabole acidose. Deze is geassocieerd met een onveranderde bloed-pH, een lage urine-pH meestal binnen de referentiewaarden, osteoporose (netto verlies van botmineraal én matrix), sarcopenie (negatieve stikstofbalans), nierstenen, verlies van nierfunctie61 en hypertensie.62
Bovenstaande is slechts een deel van wat (ultra)bewerkte voeding met ons doet. Door te focussen op een enkele nutriënt wordt de complexiteit van het probleem onderschat. Veel studies zijn gebaseerd op het ‘stofjesdenken’ en kunnen bij gebrek aan een holistische visie rechtstreeks naar de prullenbak. Natrium lijkt de schuld te hebben gekregen van talrijke veranderingen die simultaan zijn opgetreden in de samenstelling van onze voeding. Zo vond een Mendelian randomisation-studie een causaal verband tussen de natrium/kalium-ratio in urine en zowel de systolische als diastolische bloeddruk.1a,62a Uit een ultra-bewerkte voeding wordt ongeveer 500 kilocalorieën per dag meer gegeten dan uit een onbewerkte voeding.63 Bewerkte voeding bestaat uit ‘lege’ calorieën, vooral suiker en vet, met sterk gereduceerde hoeveelheden mineralen en vitaminen, en ook nog in een verkeerde balans. DiNicolantonio en Lucan64 stellen dat we ons druk maken om ‘de verkeerde witte kristallen’, waarmee ze verwijzen naar onze opgewondenheid over zout in plaats van suiker.
Zout is goed voor iedereen?
Nee. De aanbevelingen gelden alleen voor gezonde mensen. Dus niet voor patiënten met slechte nierfunctie, hoge bloeddruk, hartfalen, diabetes, etc. Een speciale categorie vormen personen met het metabool syndroom. Die lijken van buiten gezond en doen in de meeste onderzoeken trouw mee in de ‘gezonde groep’. Ze gaan niet door als ‘ziek’, maar hebben een hoog risico op (onder andere) diabetes, hart- en vaatziekte en ook op ernstige COVID-19. Ze zijn veelal leptine- en insulineresistent en ook zoutsensitief.65
Wat weinig bekendheid geniet is dat insuline ook een vasoactief hormoon is. Het beïnvloedt nagenoeg ieder segment van het nefron en bevordert daarmee, via diverse transporters, een sterke terugresorptie van natrium.66 Bij insulineresistentie veroorzaakt de compensatoire hyperinsulinemie een verhoogde insulineafhankelijke terugresorptie van natrium in de nieren, maar is de insulineafhankelijke vasodilatatie gecompromitteerd. Het gevolg is (essentiële) hypertensie.67 Andere risicofactoren voor zoutsensitiviteit zijn hoge leeftijd, hypertensie, Afro-Amerikaanse achtergrond, chronische nierziekte, pre-eclampsie in voorgeschiedenis, en een laag geboortegewicht.68-70 Bij een hogere zoutinname stijgt de bloeddruk van zoutsensitieve personen met 5-6 mm Hg.71 Zij zijn degenen die moeten uitkijken met veel zout. Het beste advies voor mensen met het metabool syndroom is om af te vallen en er een veel gezondere leefstijl op na te houden.
Wat zijn de bottom lines?
Aanbevelingen zijn bedoeld voor gezonde mensen en die kunnen meer natrium aan dan de huidige aanbevelingen suggereren. Mensen met het metabool syndroom zijn veelal zoutsensitief. Die conditie dient niet als ‘gezond’ te worden beschouwd. Voor ons allen geldt dat het niet alleen om natrium gaat, maar vooral om de balans met andere voedingsstoffen, met name kalium, calcium/magnesium en het zuur-base-evenwicht. Kortom, het gaat om de balans in onze voeding die ons gedurende de evolutie heeft gemaakt tot wat we nu nog steeds zijn.72,73 De mens is geëvolueerd op een hoge inname van kalium, magnesium en bicarbonaat uit groente en fruit.12,62,74,75 Door in de loop van de tijd onze oervoeding (deels) te vervangen door (ultra)geraffineerde kale kilocalorieën hebben we onze oerbalans steeds verder verstoord.