Chronische longaandoeningen zoals astma, chronische obstructieve longziekte (COPD) en cystic fibrosis (CF), gaan opvallend vaak gepaard met darmaandoeningen of darmsymptomen.1-5 Andersom hebben patiënten met maag-darmaandoeningen een grotere kans op het ontwikkelen van longaandoeningen.6,7
Kortom, er zijn steeds meer aanwijzingen voor de immunologische relatie tussen de darmen en de longen.8,9 In dit artikel een overzicht van de vitale communicatie tussen deze twee met slijmvlies beklede holten van het menselijk lichaam.10
De darmmicrobiota lijkt een belangrijke rol te spelen in de communicatie tussen darmen en longen. Diverse longaandoeningen gaan immers gepaard met veranderingen in de darmmicrobiota.11-13
Aangezien zowel de long- als de darmmucosa in contact staan met de buitenwereld lijkt het aannemelijk dat beide organen microbiota delen en dat deze microbiota lokale en systemische immuniteit/ inflammatie kunnen induceren. Er is toenemend bewijs dat de darmmicrobiota een belangrijke rol speelt bij de ontwikkeling van astma, COPD, CF, longkanker en longinfectie.14,15,16
Hoewel de darm en de respiratoire microbiota qua samenstelling en epitheel verschillend zijn, komen ze voort uit dezelfde embryonale structuur, zijn de anatomische structuren en functies vergelijkbaar en vertoont de microbiële kolonisatie van de longen en darmen gelijkenissen.
De darmmicrobiota wordt beïnvloed door diverse factoren zoals medicatie, voeding en wijze van geboorte.
Antibioticagebruik in het vroege leven, fastfood, keizersnede en kunstvoeding zijn positief gecorreleerd met een toegenomen kans op astma, terwijl een voeding rijk aan vezels, vaginale geboorte en borstvoeding negatief gecorreleerd zijn met astma.17,18
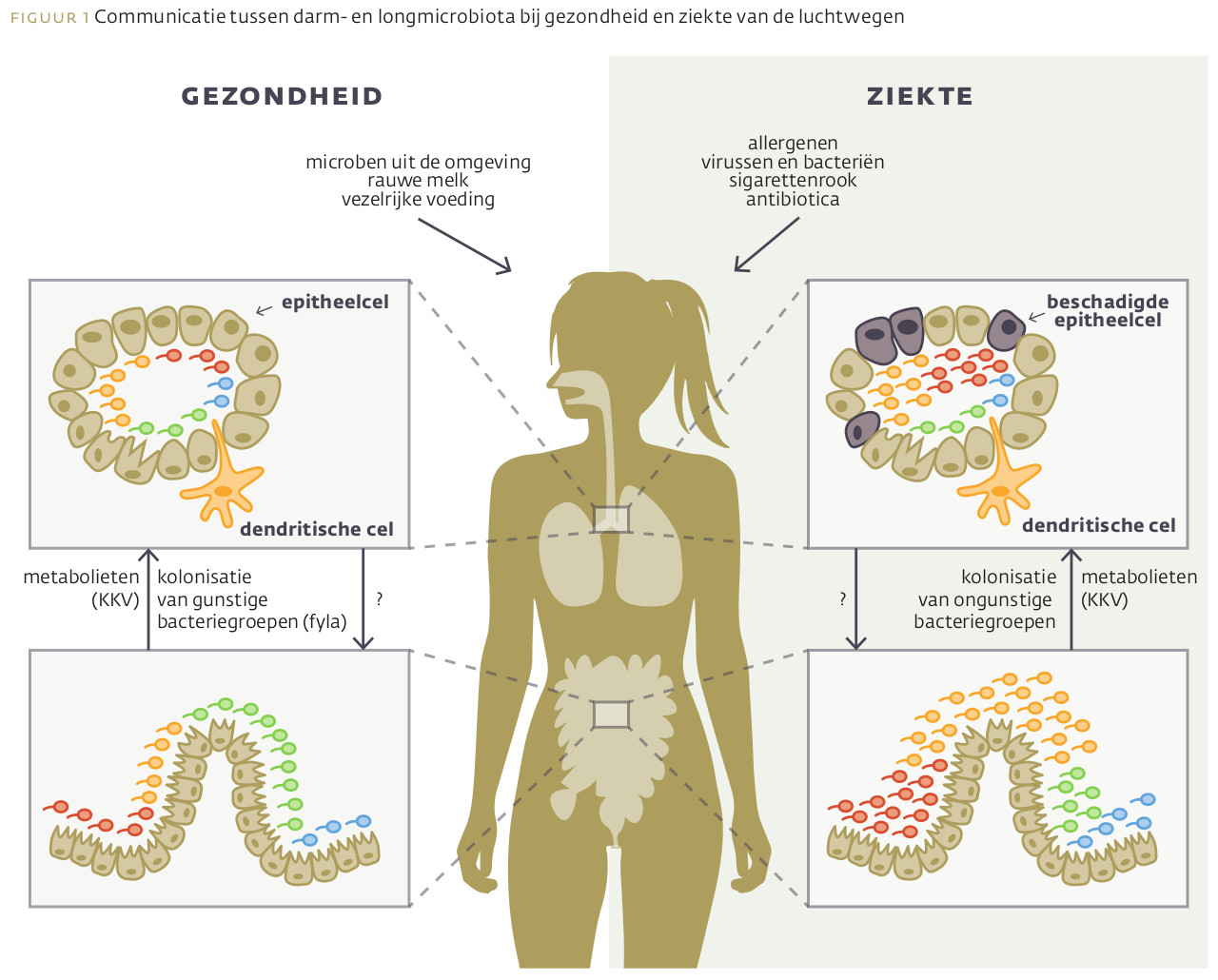
Gezonde mensen hebben darm- en luchtwegmicrobiota met diverse hoofdgroepen (fyla) van bacteriën, gedomineerd door bacteroidetes en firmicutes. Tijdens ziekten van de luchtwegen is er sprake van dysbiose in zowel de darmmicrobiota als de luchtwegmicrobiota, die zich uit in een overgroei van proteobacteriën en firmicutes. De darmmicrobiota beïnvloedt de microbiële samenstelling van de longen en de immuunrespons door directe kolonisatie van de ademhalingswegen met bacteriën en de distributie van bacteriële metabolieten, zoals korteketenvetzuren (KKV’s), die de groei van bepaalde KKV-producerende bacteriën stimuleren (bacteroidetes) en/of zich direct gedragen als immuunmodulerende moleculen10 (zie afbeelding 1).
Astma
Dankzij nieuwe DNA-technologie is er een toenemend aantal studies die een relatie aantonen tussen de darmmicrobiota en astma. De darmmicrobiota van een astma-patiënt is anders dan die van gezonde controles. Er is namelijk een verband tussen een lage diversiteit in het darmmicrobioom van zuigelingen en astma in de kindertijd.11 De diversiteit in het microbioom is lager bij kinderen die kunstmatige zuigelingenvoeding krijgen. Borstvoeding lijkt om die reden een beschermd effect te hebben tegen astma en allergische aandoeningen bij kinderen.19 Uit studies blijkt ook een sterke associatie tussen specifieke bacteriën en astma.20,21,22 Zo komen clostridium en Eggerthella lenta in grotere getale voor in de darm van astmapatiënten dan in die van gezonde controles. Een verlaagde hoeveelheid bifidobacterium, akkermansia en faecalibacterium en een verhoogde hoeveelheid candida en rhodotorula vergroten bij kinderen de kans op het ontwikkelen van astma en allergie. In tegenstelling tot gezonde mensen, laten mensen met astma een overrepresentatie zien van proteobacteriën (in het bijzonder haemophilus, moraxella en neisseria spp.) en firmicutes (lactobacillus spp.), terwijl het aandeel van bacteroidetes (specifiek prevotella spp.) significant verlaagd is.23,24
Onderzoekers hebben getracht zowel de immuunrespons van de longen te beïnvloeden als astma te voorkomen en te behandelen door het verbeteren van de darmmicrobiota. In een recent gepubliceerde studie kon interventie met probiotica bij zwangere vrouwen en hun baby’s kinderen die met keizersnede geboren waren beschermen tegen het ontwikkelen van allergie tot aan de leeftijd van dertien jaar.25 In een andere studie met 160 astmatische kinderen konden onderzoekers aantonen dat Lactobacillus paracasei, Lactobacillus fermentum en hun combinatie de ernst van astma kunnen verminderen en de astmacontrole kunnen verbeteren.26 Er zijn echter ook studies met minder succesvolle resultaten.27 In deze studies had het toedienen van probiotica zoals lactobacillus en bifidobacterium gedurende zeven weken tot zes maanden geen beschermend of therapeutisch effect op kinderen met een hoog risico op astma of op astmatische patiënten.
Ondanks de tegenstrijdige resultaten kan de potentie van probiotica bij voorkomen en behandelen van astma niet ontkend worden. Het is immers duidelijk dat de darmmicrobiota sterk geassocieerd is met astma. Een disbalans houdt verband met een verhoogd risico op en ernst van astma. Dat betekent dat beïnvloeding van de darmmicrobiota een haalbare manier kan zijn om astma te voorkomen en te behandelen. Probiotica kunnen de functie van het immuunsysteem reguleren en inflammatie beïnvloeden op een stamspecifieke manier. De keuze van de bacteriestam en de dosering zijn hierin bepalend voor een gunstig effect.
COPD
COPD is een longziekte waarbij de longen zijn beschadigd. Ademen is moeilijker en er is sprake van vermoeidheid. De afkorting COPD staat voor chronic obstructive pulmonary disease. Hoewel er veel onderbouwing is voor het samengaan van COPD en chronische maag-darmaandoeningen zoals prikkelbaredarmsyndroom (PDS), zijn er weinig studies die rapporteren over de samenstelling van de darmmicrobiota van COPD-patiënten. Toch zijn er aanwijzingen dat de darmmicrobiota een rol speelt in COPD als gevolg van rookgedrag. Biedermann et al. vonden een afwijkende darmmicrobiota bij gezonde rokers vergeleken met niet-rokers en ze stelden een toename vast van de fyla actinobacteria en firmicutes en een daling van bacteroidetes en proteobacteriën na het stoppen met roken.28
Ook zijn er relatief weinig studies waarin gekeken is naar het effect van probiotica op COPD. Toediening van Lactobacillus rhamnosus en Bifidobacterium breve in de maag van muizen met COPD verminderde luchtweginflammatie en schade aan longblaasjes.29 In vitro hadden deze twee bacteriestammen een vergelijkbaar anti-inflammatoir effect op sigarettenrook-geïnduceerde inflammatie in menselijke macrofagen.30
Cystic fibrosis
Cystic fibrosis (CF) staat ook wel bekend als taaislijmziekte. Het is een erfelijke, chronische en ongeneeslijke ziekte. Deze autosomale recessieve ziekte beïnvloedt voornamelijk de longen, aangestuurd door een genmutatie, de zogenaamde CFTR-mutatie.
Ook het maag-darmkanaal vertoont deze CFTR-disfunctie en is als eerste aangedaan bij CF-patiënten, wat een aanwijzing is voor een sterk verband tussen de darmen en de longen. Het darmmicrobioom van CF-patiënten is significant afwijkend van dat van gezonde controlepersonen, waarbij de soortdiversiteit en de soortrijkdom verlaagd zijn.31,32,33 In een studie bij kinderen met CF vonden onderzoekers verhoogde aanwezigheid van staphylococcus, streptococcus en Veillonella dispar en verminderde aanwezigheid van bacteroides, Bifidobacterium adolescentis en Faecalibacterium prausnitzii in de darmen vergeleken met gezonde controlepersonen.38 Sterker nog, de darmmicrobiota lijkt essentieel voor de pathofysiologie en ontwikkeling van CF. Verscheidene cross-sectionele studies laten een relatie zien tussen het darmmicrobioom en de longfunctie, het opvlammen en de ernst van de ziekte.34-36
In de afgelopen jaren hebben diverse gecontroleerde studies laten zien dat herstel van de darmmicrobiota, gevolgd door suppletie met probiotica, leidt tot verbetering van CF. Dat bevestigt dat de darmmicrobiota luchtweginflammatie kan beïnvloeden bij CF. Toediening van Lactobacillus reuteri leidde tot een reductie in bacteriële dichtheid en een toename van microbiële diversiteit in de darm.37
Bovendien heeft het toedienen van probiotica gunstige effecten op het risico van verergering en op kwaliteit van leven van CF-patiënten.39
Er zijn echter ook CF-studies met tegenovergestelde resultaten.40 Het is dan ook niet verrassend dat de conclusie van een recente Cochrane review is dat er meer RCT’s nodig zijn om de specifieke probiotische stammen en hun dosis te bepalen die van nut zijn voor CF-patiënten.41
Luchtweginfectie
Een luchtweginfectie of respiratoire infectie is een ontsteking van het slijmvlies in de luchtwegen. In de ingeademde lucht kunnen zich allerlei ziekteverwekkers bevinden, zoals virussen en bacteriën.
Infecties van de bovenste luchtwegen, zoals verkoudheid en keelontsteking, worden meestal veroorzaakt door een virus en gaan vrijwel altijd zonder behandeling over. Infecties van de lagere luchtwegen zijn bijvoorbeeld longontsteking en bronchitis. Deze kunnen zowel door een virus als een bacterie worden veroorzaakt en kunnen leiden tot een ernstige ziekte. Longontsteking is een belangrijke doodsoorzaak in Nederland.
In de afgelopen jaren is er veel geschreven over de long-darm-as in relatie tot bacteriële en virale infecties.42 Het lijkt erop dat de darmmicrobiota de macrofagen in de longblaasjes kan versterken in hun functie. Op die manier is de darmmicrobiota een beschermende factor tijdens longontsteking.43 De darmmicrobiota van kinderen met een luchtweginfectie is afwijkend van die van gezonde controles.44
Uit meerderde studies blijkt dat orale toediening van probiotica niet alleen beschermt tegen een bacteriële longinfectie, maar ook bijdraagt aan het een versneld herstel van een virale luchtweginfectie.45,46,47 Dit bevestigt de cruciale rol van de darmmicrobiota bij luchtweginfecties.
Op fylumniveau zijn actinobacteriën en proteobacteriën – waaronder veel pathogene soorten vallen – in grotere getale aanwezig in de darm van tuberculose (TB)-patiënten, terwijl bacteroïdeten, die juist diverse gunstige soorten bevatten, verlaagd aanwezig zijn bij TB-patiënten in vergelijking met gezonde controlepersonen.48
Op geslachtsniveau zijn verschillende butyraat- en propionaatproducerende bacteriën, zoals faecalibacterium, roseburia, eubacterium en phascolarctobacterium, in grotere getale aanwezig in TB-patiënten dan in gezonde controlepersonen.49
Studies met probiotica wijzen uit dat suppletie met Lactobacillus plantarum MTCC 2621 de anti-Mycobacterium tuberculosis-immuniteit in de longen kan herstellen.50 Deze bevindingen duiden op een bijdrage van de darmmicrobiotia aan de pathofysiologie van TB.51
Als metadata aangeven dat oraal toegediende probiotica de impact van verkoudheid en griep kunnen helpen verminderen, vraagt menigeen zich wellicht af of ze ook iets kunnen betekenen in het bestrijden van de COVID-19-pandemie. Het is interessant dat in een recente publicatie werd gemeld dat bij patiënten met gastro-intestinale problemen, virale nucleïnezuren in hun feces en anale swabs gevonden werden.52 De auteurs stellen dat het virus bindt aan het angiotensine-converterend enzym 2 (ACE2), dat zich bevindt in de longen en in de epitheelcellen van de dunne darm. Diverse studies, waaronder één die de impact voor Amerikanen schetst, laten zien dat probiotica griepachtige luchtweginfecties significant kunnen verminderen.53
In het kader van de COVID-19-crisis raden China's National Health Commission en National Administration of Traditional Chinese Medicine probiotica aan in de behandeling van patiënten met een ernstige COVID-19-infectie, al is het maar om een secundaire bacteriële infectie te voorkomen.52
Mogelijke mechanismen
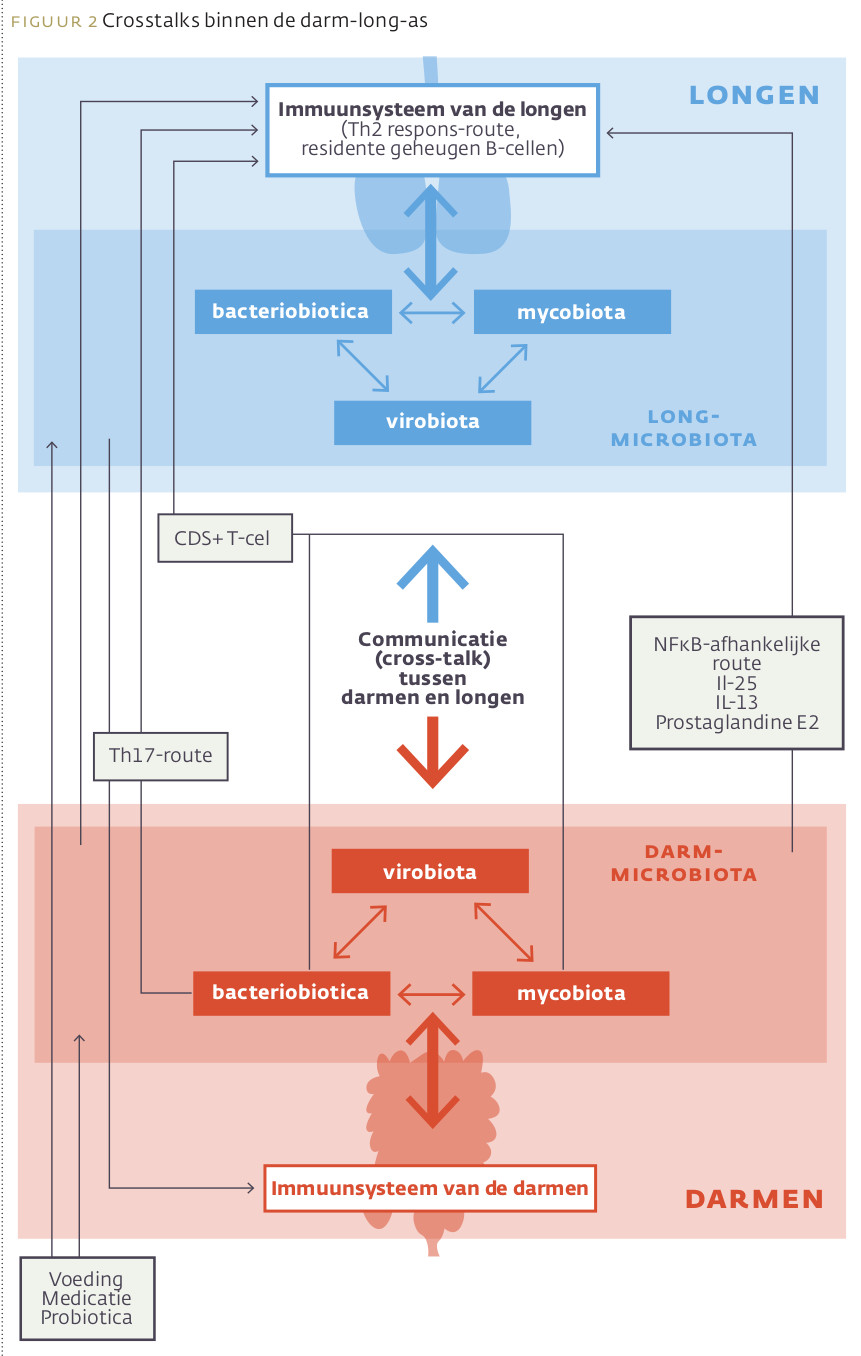
Tot mogelijke mechanismen behoren de regulatie van de extra-intestinale T-celpopulaties (witte bloedcellen), de ontwikkeling van orale immuuntolerantie door regulatoire T-cellen (Tregs), productie van korteketenvetzuren (KKV’s) en de regulatie van systemische inflammatie door de darmmicrobiota (zie afbeelding 2).
Bacteriobiota, mycobiota en virobiota hebben een sterke communicatie in zowel de long als in de darm. Ze beïnvloeden elkaar via zowel directe als indirecte mechanismen. Daarnaast beïnvloedt de darmmicrobiota zowel het immuunsysteem van de darm als dat van de longen via lokale of distale (richting de longen) interacties, waarbij CD8+-T-cellen, Th17, IL25, IL13, prostaglandine E2 en/of NFκB–afhankelijke stofwisselingspaden betrokken zijn. De longmicrobiota beïnvloedt de mucosale immuniteit en draagt bij aan immuuntolerantie door het aantrekken van neutrofielen, productie van pro-inflammatoire cytokines gemedieerd door receptor 2 (TLR2) en het vrijmaken van anti-microbiële peptiden, zoals bèta-defensine-2 gestimuleerd door T-helper 17 (Th17) cellen.
Omgekeerd beïnvloedt de longmicrobiota het immuunsysteem van de darm, maar het exacte mechanisme hierachter moet nog ontrafeld worden. Het is wel zo dat verstoring van de darmmicrobiota is geassocieerd met Th17 celmediatie na longinfectie door een influenzavirus.54
De immuuncellen en cytokines die door de darmmicrobiota en hun metabolieten (onder andere KKV’s) gestimuleerd worden, kunnen de circulatie ingaan via bloed en lymfe, waarna ze de immuun- en inflammatoire responses in de longen reguleren en aldaar de gezondheid van de luchtwegen beïnvloeden.
Probiotica
Er zijn diverse factoren die invloed hebben op de samenstelling van de darm- en/of longmicrobiota, zoals voeding, medicatie en probiotica. Sinds er meer bekend is over de mogelijk beschermende en therapeutische effecten van probiotica bij luchtwegaandoeningen groeit het aantal onderzoeken met betrekking tot dit thema.55 Onderstaande een greep uit de resultaten van diverse studies met probiotica.
Bifidobacterium bifidum kan de Th1/Th2-balans ondersteunen en IFNγ-, IL4-, en IL12-secretie in de milt upreguleren.56 Escherichia coli Nissle 1917 kan het aantrekken van inflammatoire cellen en de Th2- en Th17-respons in de luchtwegen verminderen.57 Enterococcus faecalis onderdrukt de ontwikkeling van Th17-cellen in de longen, milt en darm.58 Lactobacillus plantarum kan de aantallen van niet-specifieke immuuncellen in de longen (macrofagen en neutrofielen) en cytokinespiegels (IL6 en TNFα) in de vloeistof in de longblaasjes (BALF) verminderen en de immunosuppressieve Treg-respons in de longen stimuleren.59 Het regulerende effect van probiotica op de expressie van Toll-like receptoren (TLR’s) is bij diverse ziektebeelden vastgesteld.60 Probiotica verminderen inflammatie door het beperken van de expressie van TLR4.61 In een pilotstudie uitgevoerd op intensive care units naar de toepassing van L. rhamnosus GG bij ernstig zieke patiënten met longontsteking als gevolg van kunstmatige beademing werden gunstige effecten vastgesteld.62 L. reuteri DSM 17938 liet positieve effecten zien bij bovenste luchtweginfecties en gastro-intestinale klachten bij kinderen.63 Een vergelijkbaar effect werd bereikt met L. reuteri ATCC 55730 bij productiemedewerkers in Zweden.64
Ondanks al deze mooie voorbeelden zijn de exacte mechanismen achter de effecten van probiotica op de longen en op de diverse aspecten van de regulatie van de immuunrespons nog grotendeels onbekend.
Conclusie
Een toenemende hoeveelheid literatuur bevestigt de belangrijke en complexe ‘crosstalk’ tussen de darm en de longen, via de darmmicrobiota en het immuunsysteem.
Dysbiose in de darm lijkt geassocieerd met de etiologie en ontwikkeling van luchtwegaandoeningen, zoals astma, COPD, CF, longkanker en luchtweginfecties. Op dit moment staat de kennis over het precieze mechanisme dat betrokken is bij de long-darm-as nog in de kinderschoenen. Toekomstig onderzoek naar gerichte beïnvloeding van het darmmicroboom met voeding, probiotica en fecestransplantatie en naar het bereiken van balans tussen darm- en longimmuniteit is nodig voor het ontwikkelen van nieuwe en effectieve behandelopties voor luchtwegaandoeningen.