Onze levensverwachting bij de geboorte is sterk gestegen. Dit gegeven horen we tegenwoordig dagelijks, want ons pensioen staat op de tocht. De huidige lange levensverwachting is in hoge mate op het conto te schrijven van de verworvenheden van onze cultuur, waaronder de landbouwrevolutie (ongeveer 10.000 jaar geleden), het organiseren van een volksgezondheid en de verandering van ons gedrag, waarmee we enkele ongunstige leefomstandigheden van onze voorouders, respectievelijk hongersnoden, (kinder)infectieziekten en geweld, grotendeels hebben weten uit te bannen. Deels is dit uiteraard ook op het conto van de Gezondheidszorg. Echter, onze levensverwachting zonder chronische ziekten daalt(1) en dat komt vooral vanwege de toename van de degeneratieve, typisch westerse, ziekten die centreren rond het ‘metabool syndroom’.2
Onze levensverwachting bij de geboorte is sterk gestegen. Dit gegeven horen we tegenwoordig dagelijks, want ons pensioen staat op de tocht. De huidige lange levensverwachting is in hoge mate op het conto te schrijven van de verworvenheden van onze cultuur, waaronder de landbouwrevolutie (ongeveer 10.000 jaar geleden), het organiseren van een volksgezondheid en de verandering van ons gedrag, waarmee we enkele ongunstige leefomstandigheden van onze voorouders, respectievelijk hongersnoden, (kinder)infectieziekten en geweld, grotendeels hebben weten uit te bannen. Deels is dit uiteraard ook op het conto van de Gezondheidszorg. Echter, onze levensverwachting zonder chronische ziekten daalt(1) en dat komt vooral vanwege de toename van de degeneratieve, typisch westerse, ziekten die centreren rond het ‘metabool syndroom’.2
Laatstgenoemde is de combinatie van een te hoog lichaamsgewicht, een verstoorde glucosehomeostase, hoge bloeddruk en atherosclerose-bevorderende afwijkingen in de plasmalipiden (triglyceriden, HDL- en LDL-cholesterol). Dit zogenaamde ‘dodelijke kwartet’ vormt een risico op diabetes mellitus type 2, hart- en vaatziekten, bepaalde vormen van kanker (borst, colorectaal, pancreas), neurodegeneratieve ziektes (o.a. de ziekte van Alzheimer), zwangerschapscomplicaties (zwangerschapsdiabetes, pre-eclampsie), fertiliteitstoornissen (polycystisch ovariumsyndroom) en diverse andere ziektes die karakteristiek zijn voor onze huidige obesogene maatschappij.
De symptomen van het metabool syndroom zijn vooral op een klinische diagnose gericht. Veel aandacht gaat uit naar een te hoog lichaamsgewicht, maar dat is niet helemaal terecht. Ongeveer 17 - 30 % van de mensen met obesitas heeft geen noemenswaardige risicofactoren voor diabetes mellitus type 2 en hart- en vaatziekten, hetgeen ook wel healthy obesity’ wordt genoemd.3 Andersom hebben personen met een laag lichaamsvetgehalte en een slechte fysieke conditie meer risico op overlijden aan hart- en vaatziekten dan obese personen met een goede fysieke conditie.4 Om deze discrepantie te omzeilen kan het ‘metabool syndroom’ beter vanuit een pathofysiologisch perspectief benaderd worden, waarbij het wordt omschreven als het ‘insulineresistentiesyndroom’.2
Uitgaande van de groei van onze hersenen tijdens de evolutie wordt uitgelegd waarom de mens zo gevoelig is voor het ontstaan van insulineresistentie.5 Vervolgens worden omstandigheden besproken waaronder onze hersenen in hun energievoorziening worden bedreigd en hoe ons lichaam dit tracht te voorkómen. Beargumenteerd wordt dat onze huidige westerse leefstijl de oorzaak is van vele valse inflammatoire signalen die achtereenvolgens leiden tot een toestand van chronische systemische lagegraadontsteking, insulineresistentie, het metabool/insulineresistentiesyndroom en bovengenoemde, typisch westerse, welvaartsziekten. Ten slotte wordt uiteengezet dat we voor het vinden van een oplossing terug in de tijd moeten gaan.
Onze hersengroei heeft ons gevoelig gemaakt voor glucoseschaarste
Gedurende de afgelopen 2,5 miljoen jaar, overeenkomend met de tijd van de Homo erectus, zijn onze hersenen sterk gegroeid van ongeveer 400 mL tot de 1.400 mL van de huidige dag. Ter vergelijking: onze naaste verwante, de chimpansee, heeft als volwassene een hersenvolume van 400 mL, hetgeen gelijk is aan het hersenvolume van onze pasgeborenen. Waarschijnlijk werd onze hersengroei mogelijk omdat onze verre voorouders het land-waterecosysteem hadden ontdekt en dit gingen exploiteren. Ze vonden hierin een gemakkelijk benutbare bron van hoogwaardige voeding. Deze voeding was rijk aan de ‘hersenspecifieke’ nutriënten jodium, selenium, vitamines A en D, en de visolievetzuren eicosapentaeenzuur (EPA) en docosahexaeenzuur (DHA).6-9 De voeding was tevens de drijvende kracht voor de overgang van vegetariër naar omnivoor, hetgeen o.a. te zien is aan onze relatief lange dunne darm en relatief korte dikke darm,10 onze kaken, tanden en kiezen, de efficiënte opname van heem-ijzer, en onze behoefte aan vitamine B12.
Tijdens de evolutie ging de groei van onze hersenen gepaard met diverse aanpassingen van onze anatomie en ons metabolisme. Onder de landzoogdieren bestaat een lineair verband tussen lichaamsgewicht en basaal metabolisme.11 Van dit basaal metabolisme consumeert ons brein maar liefst 23 % en dit moest dus ten koste gaan van andere organen, met name onze spieren.11 Het erop nahouden van grote hersenen is dus een metabole luxe: er is geen enkele andere diersoort die zo’n hoog percentage van zijn basaal metabolisme moet investeren voor de instandhouding van zijn brein. Daarbij komt eveneens dat de energie voor de hersenen nagenoeg volledig verkregen wordt uit glucose. Hiervan gebruiken ze 130 gram per dag, hetgeen overeenkomt met ongeveer twee derde van de 200 gram glucose die we per dag nodig hebben.9 Het is belangrijk dat onze hersenen die bron van energie krijgen, want in tegenstelling tot andere organen kan hierop niet worden bezuinigd. Een tekort leidt al snel tot irreversibele beschadigingen of zelfs de dood. In dit kader wordt wel eens gesproken over het ‘zelfzuchtige brein’.9,12
Omstandigheden van glucoseschaarste: zwangerschap en ontsteking
We verkrijgen onze energie uit de verbranding van vetten (9,2 kcal/g), eiwitten (4,2 kcal/g), koolhydraten (4,2 kcal/g) en alcohol (7,2 kcal/g). Ons lichaam bevat grote voorraden vet (10 - 15 kg) en eiwit (6 - 7 kg, waarvan alles functioneel), maar slechts een kleine voorraad koolhydraat in de vorm van glycogeen in de spieren (350 g; niet mobiliseerbaar) en lever (80 g; mobiliseerbaar), alsmede extracellulair glucose (20 g). Bij hongeren zijn die voorraden theoretisch voldoende voor een overleving van ongeveer 35 dagen (vet), 15 dagen (eiwit), 15 uur (spierglycogeen) 3,5 uur (leverglycogeen) en 40 minuten (extracellulair glucose).13 De manier waarop we in vastende toestand onze hersenen van de benodigde glucose voorzien is om, via de gluconeogenese, glucose in de lever te maken uit de bouwstenen van eiwitten (de ‘glucogene’ aminozuren) die zich vooral in onze spieren bevinden. Een klein deel van de glucose wordt gemaakt uit het glycerol-deel van het vet dat bij vasten samen met de vrije vetzuren uit het vetweefsel wordt gemobiliseerd.
Bij zwangerschap en bij infectie/ontsteking wordt het spannend omdat dan ook andere compartimenten een deel van de schaarse glucose opeisen. Dat zijn het groeiend kind bij zwangerschap, en het immuunsysteem in het geval van een infectie/ontsteking. Het kind staat hoog in de evolutionaire hiërarchie en bij een infectie is een adequate reactie van het immuunsysteem van essentieel belang voor de directe overleving. Weinig bekend is dat ons niet-geactiveerde immuunsysteem eenzelfde percentage van ons basaal metabolisme consumeert als onze hersenen (23 %). Hiervan komt ongeveer 47 % uit glucose en 22 % uit het glucogene aminozuur glutamine. In geactiveerde staat dient er nog meer energie naar het immuunsysteem te worden gestuurd. De activering van het immuunsysteem kost een extra hoeveelheid van 9 - 30 % van het basaal metabolisme.14,15
Insulineresistentie: mechanisme en compensatoire hyperinsulinemie
De manier om bij dreigende glucoseschaarste zowel de hersenen, het kind (zwangerschap) als het immuunsysteem (infectie) van glucose te voorzien is om insulineresistentie te veroorzaken. Hierbij worden de organen die nagenoeg uitsluitend op glucose kunnen functioneren van glucose voorzien en worden de organen die deze vorm van energie niet strikt nodig hebben gedwongen om de glucose ongemoeid te laten en over te schakelen op de benutting van de ruime vetvoorraden. De insulineresistentie zorgt ervoor dat de lever wordt aangezet om glucose en vet te maken en te distribueren (triglyceriden in VLDL) en het vetweefsel scheidt nu ook onder niet-vastende omstandigheden vrije vetzuren en glycerol uit.
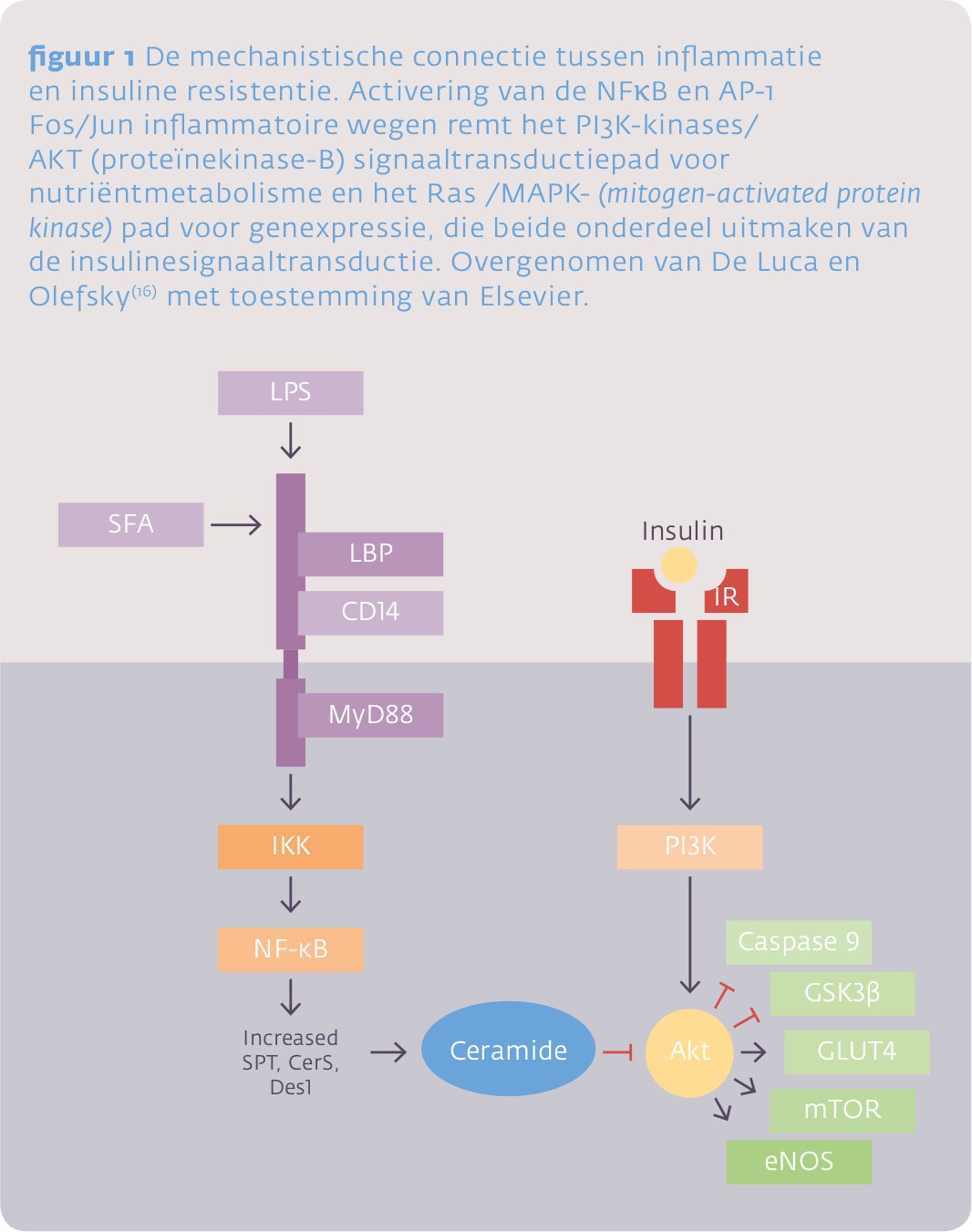
Glucoseschaarste veroorzaakt dus een reallocatie van energierijke substraten:14,15 glucose naar hersenen, foetus en immuunsysteem, en vet naar de insulineresistente organen. Mechanistisch (figuur 1) wordt de onderliggende insulineresistentie veroorzaakt door pro-inflammatoire cytokinen (waaronder TNF-α), die afkomstig zijn uit de placenta (zwangerschap) of het geactiveerde immuunsysteem (infectie). Activering van Toll-likereceptoren (TLR, zoals de TLR-4) door inflammatoire elementen (zoals lipopolysaccharide, LPS; zie beneden) en activering van cytokinereceptoren door cytokines, veroorzaken activering van de NF-κB en AP-1 Fos/Jun inflammatoire wegen, die de insulinesignaaltransductie remmen op het niveau van PI3K-AKT (invloed van insuline op de glucoseopname en andere metabole wegen, zoals de remming van de gluconeogenese) en op het niveau van Ras/MAPK (insulineactie op genexpressie, waaronder genen voor celgroei en differentiatie).16
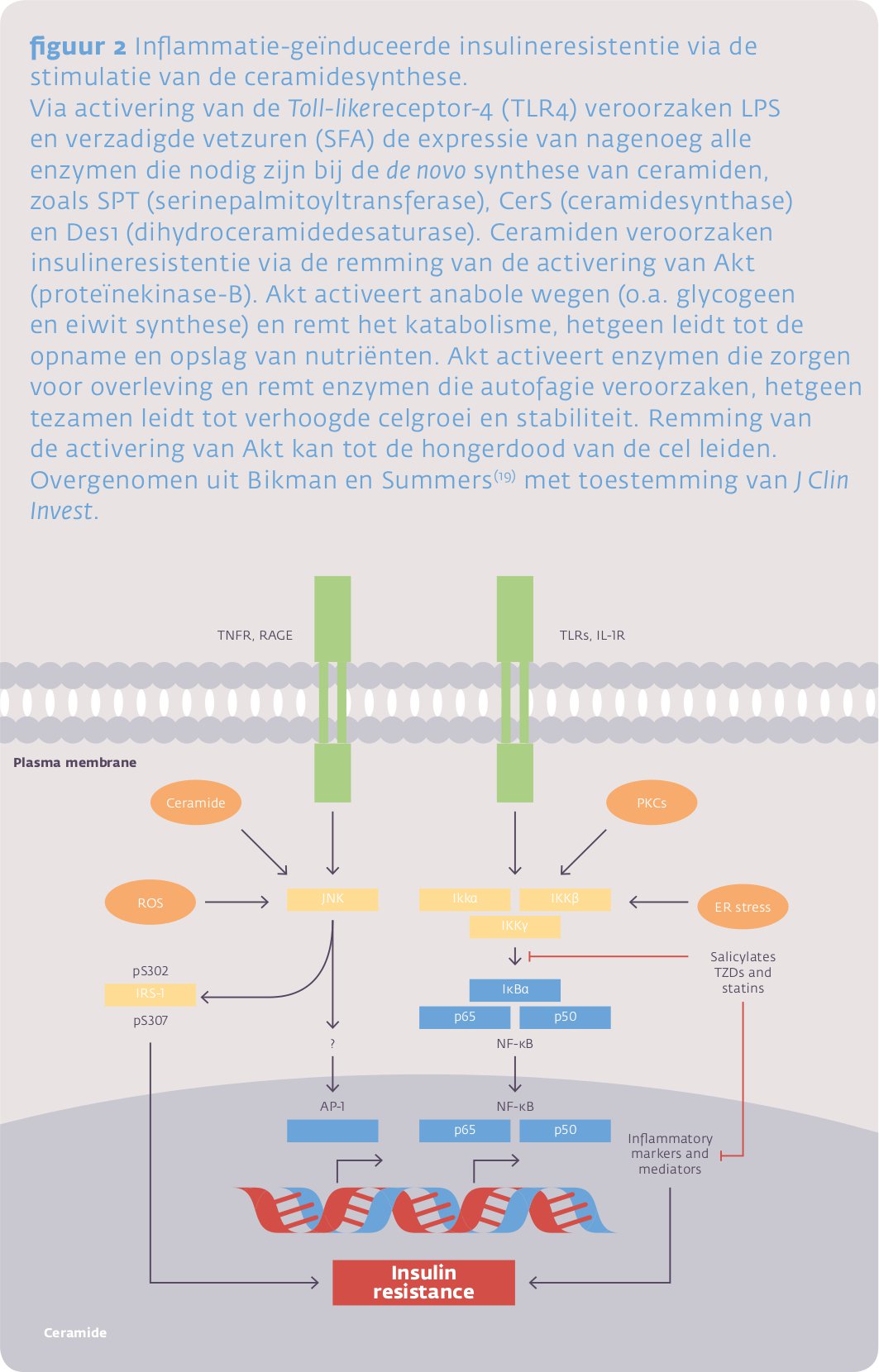
Activering van de TLR-4 door LPS leidt eveneens tot de novo synthese van ceramiden (figuur 2), hetgeen niet alleen structurele onderdelen zijn van de sfingolipiden in membranen, maar bij verschillende stress-stimuli eveneens als secundaire signaalstoffen fungeren. Ceramiden worden onder deze omstandigheden ook gemaakt uit de reeds aanwezige sfingolipiden. De hierbij betrokken sfingomyelinases behoren tot de acutefaseproteïnen. De gevormde ceramiden kunnen systemische inflammatie veroorzaken maar, andersom, bij hun verwijdering uit cellen bescherming bieden tegen systemische stressoren. Na de injectie van LPS worden door de lever ceramiden geproduceerd die vervolgens vooral verschijnen in VLDL en LDL. Een verhoogd ceramidegehalte in LDL verhoogt de atherogeniciteit. Het vergemakkelijkt LDL-aggregatie en de opname van LDL in macrofagen, hetgeen leidt tot de vorming van schuimcellen. LDL dat aangetroffen wordt in atherosclerotische laesies is rijk aan ceramiden.17 De opname van ceramiden door cellen of de productie hiervan in cellen kan leiden tot necrose, apoptose en remming van de celgroei.18 Hierbij remmen ze de insulinesignaaltransductie, i.e. veroorzaken insulineresistentie – op het niveau van ‘AKT’ –, hetgeen anti-anabole en katabole effecten veroorzaakt. Er ontstaat een verminderde opname van glucose, vetzuren en aminozuren, hetgeen tot de hongerdood (ceramide-afhankelijk hongeren) van de betreffende cel kan leiden.19 Ceramiden zijn belangrijke intermediairen gebleken in het ontstaan van inflammatie-geïnduceerde insulineresistentie.20 Waarschijnlijk is hun productie (figuur 2) een onderdeel van de remming van de insuline signaaltransductie zoals weergegeven in figuur 1.
Ongeacht de onderliggende complexe mechanismen die ten grondslag liggen aan het ontstaan van insulineresistentie na een inflammatoire trigger, is het in de afgelopen jaren duidelijk geworden dat ons immuunsysteem en ons metabolisme innig met elkaar zijn verweven.21 Een inflammatoire trigger leidt tot aanpassing van het metabolisme en het ontstaan van insulineresistentie is hierbij een belangrijke mediator. Bij insulineresistentie scheiden de bètacellen van de pancreas, als reactie op de dreigende verhoging van de plasmaglucosespiegel, meer insuline uit waardoor de plasmaglucosespiegel constant blijft maar de plasmainsulineconcentratie dus oploopt. Deze ‘compensatoire hyperinsulinemie’ heeft onder andere tot doel om het ontstaan van diabetes mellitus type 2 te voorkómen.
De combinatie van insulineresistentie en de compensatoire hyperinsulinemie is slechts een onderdeel van de vele aanpassingen die plaatsvinden onder inflammatoire omstandigheden. In hun volledigheid betreft het de volgende adaptaties en hieruit voortkomende directe functionele gevolgen: een verminderde insulinegevoeligheid (glucose- en vetherverdeling, hypertensie), verhoogde sympathische zenuwactiviteit (bevorderen van vetafbraak, synthese van glucose en afbraak van glycogeen), verhoogde activiteit van de HPA-as (stress: milde cortisolstijging, synthese van glucose, ontstaan van cortisolresistentie in het immuunsysteem), verlaagde activiteit van de HPG-as (daling androgenen t.b.v. synthese van glucose uit spiereiwitten, sarcopenie, een androgeen/oestrogeen disbalans, remming van seksuele activiteit en reproductie), IGF1-resistentie en het ontstaan van ‘ziektegedrag’ (sparen van energie, slaap, anorexie, minimaliseren activiteit van spieren, hersenen en darmen).15 Die adaptaties zijn bedoeld voor de korte termijn. Indien ze lang aanhouden, dan ontstaat het metabool/insulineresistentiesyndroom en uiteindelijk de ziektes die hiermee zijn geassocieerd.
Hypertensie en afwijkende circulerende lipiden
De combinatie van insulineresistentie en de compensatoire hyperinsulinemie is bij voortduring verantwoordelijk voor de meeste abnormaliteiten die we zien bij het metabool syndroom.2 Insuline heeft namelijk niet slechts een functie in het koolhydraat-, eiwit- en vetmetabolisme maar is o.a. ook betrokken bij de vaattonus, elektrolythuishouding en bij groei en differentiatie. Sommige van deze functies worden door de insulineresistentie onderdrukt (ze zijn ‘insulineresistent’) terwijl andere intact blijven en vanwege de compensatoire hyperinsulinemie overvloedig worden gestimuleerd. Zo ontstaat hypertensie omdat de insuline-afhankelijke (NO-gemedieerde) vasodilatatie door de insulineresistentie wordt gecompromitteerd, terwijl de insuline-afhankelijke terugresorptie van natrium in de nier intact is en door de hyperinsulinemie overvloedig wordt gestimuleerd. Er ontstaat dus een combinatie van onvoldoende vasodilatatie en zoutretentie: de patiënt wordt zeer gevoelig voor zout en de bloeddruk gaat omhoog.22 Mogelijk is het zuiniger omgaan met zout onder deze omstandigheden een evolutionair geconserveerd mechanisme, dat voorkómt dat bij het verwijderen van het infectieuze materiaal uit het maag-darmkanaal (d.m.v. diarree en braken) een levensbedreigende vorm van uitdroging ontstaat.
De veranderingen in de vethuishouding zijn, zoals gezegd, bedoeld voor het sturen van vet (stijging triglyceriden in VLDL en vrije vetzuren) naar de insulineresistente organen. Naast deze distributie van energie en de uitscheiding van de reeds genoemde ceramiden als secundaire inflammatoire signaalstoffen, heeft de aanpassing van de vethuishouding nog tenminste twee andere doelen.23-27 De triglyceriden en het cholesterol in ons plasma bevinden zich in de lipoproteïnen (chylomicronen, VLDL, LDL, HDL) en die hebben het vermogen om lipopolysaccharide (LPS) te binden aan hun fosfolipidenoppervlak. LPS is onderdeel van de celwand van gramnegatieve bacteriën. De detectie van LPS via de Toll-likereceptor-4 (TLR4; zie boven) is een krachtig signaal voor het ontstaan van een ontstekingsreactie. Na binding van LPS aan een lipoproteïne wordt het afgevoerd via de gal.
In normaal plasma betreft het vooral het HDL (het ‘oppervlaktelipoproteïne’) omdat deze lipoproteïneklasse uit de meeste partikels bestaat, en het grootste aandeel aan fosfolipiden en oppervlak bevat. Door de binding van LPS aan het oppervalk van de lipoproteïnen en hun daaropvolgende verwijdering via de darm wordt voorkómen dat dit deel van het LPS een interactie aangaat met de TLR4. De LPS-geïnduceerde immuunreactie wordt hiermee dus beperkt. In kritisch zieke patiënten stijgt vanwege de insulineresistentie het VLDL en wordt dit lipoproteïne daarmee de belangrijkste binder van LPS. Van de LPS-bindende eigenschappen van HDL moet onder deze omstandigheden minder worden verwacht, omdat het gehalte hiervan bij ontsteking daalt en de HDL-deeltjes sterk van karakter veranderen (zie beneden).27
De veranderingen in de vethuishouding die ontstaan als reactie op de ontsteking en insulineresistentie zijn ook van belang voor het herstel van de schade die vanwege de inflammatie ontstaat. Die schade wordt niet alleen veroorzaakt door de infectieuze bron, maar ook door het immuunsysteem, dat, indien niet in toom gehouden, het vermogen heeft om ons te doden.28 Vanwege de verhoogde productie van triglyceriden (VLDL) door de lever, maar vooral hun slechtere klaring door lipoproteïnelipase (een door de insulineresistentie getroffen proces), daalt het HDL en ontstaan tevens kleine LDL-partikels die gemakkelijk oxideren en glyceren. Het nog aanwezige HDL verandert van functie, waardoor het niet zo goed meer in staat is om cholesterol uit de weefsels op te halen en terug te voeren naar de lever in het proces dat wordt aangeduid met het ‘cholesterol-terugtransport’. Ook verandert het HDL van anti-inflammatoir naar pro-oxidatief en pro-inflammatoir, mogelijk omdat het gaat meehelpen in de afweerreactie. Dat is dus wat anders dan ‘dysfunctional’:29 het is verstandig om de evolutionair tot stand gekomen normale reactie van het lichaam te proberen te begrijpen, alvorens er een negatief waardeoordeel aan te hechten. Er zijn onder inflammatoire omstandigheden diverse mechanismen die het cholesterol-terugtransport actief remmen en daarmee bevorderen dat het cholesterolgehalte in de weefsels, waaronder de vaten, stijgt.30 Waarschijnlijk is ook het vormen van de kleine, zeer atherogene, LDL-partikels functioneel omdat ze slecht door de LDL-receptor worden geklaard, op eenvoudige wijze de vaatwand binnendringen en door hun binding aan de subendotheliale matrix cholesterol naar de beschadigde plekken brengen. Cholesterol is mogelijk nodig voor het herstel van de schade aan de membranen die veroorzaakt is door de infectie en het immuunsysteem.17
De ontstane afwijkingen in de plasmavetgehaltes, i.e. de hoge triglyceriden (VLDL), het lage HDL en de zeer atherogene kleine LDL-deeltjes, zijn karakteristiek voor het metabool/insulineresistentiesyndroom en worden gezamenlijk ook wel ‘de atherogene lipidentrias’ genoemd. Die ‘afwijkingen’ behoren dus evenals de zoutgevoeligheid tot de normale reactie van ons lichaam op een infectie of ontsteking.
De vraag rijst waarom die evolutionair geconserveerde overlevingsstrategie vandaag de dag leidt tot de ziekten die voortkomen uit het metabool syndroom. Het antwoord is: omdat we met de nog steeds toenemende veranderingen van onze leefstijl sinds de landbouwrevolutie (zo’n 10.000 jaar geleden) tal van valse ontstekingssignalen hebben geïntroduceerd die levenslang aanhouden en die via de bovengenoemde volstrekt normale mechanismen op lange termijn leiden tot ziektes waarop de evolutie via het gangbare proces van mutatie/selectie niet heeft geselecteerd en ook niet zal selecteren zolang deze ziekten geen invloed hebben op onze fertiliteit en de sterfte vóór het bereiken van de reproductieve leeftijd.
Valse inflammatoire prikkels uit onze leefstijl
Een inflammatoire reactie is de uiting van een geactiveerd immuunsysteem dat reageert op een steriele infectie of ons tracht te beschermen tegen binnengedrongen pathogenen. Een inflammatoire reactie die is gestart moet dan ook worden gestopt; de schade die een ontketend immuunsysteem kan aanrichten is soms erger dan de kwaal.28 Bij dit stoppen zijn o.a. de visolievetzuren eicosapentaeenzuur (EPA) en docosahexaeenzuur (DHA) betrokken. Dit proces ligt ten grondslag aan de anti-inflammatoire eigenschappen van visolie. In 2003 bedroeg in Nederland de som van de EPA- en DHA-inname door volwassenen ongeveer 90 mg/dag, terwijl de huidige aanbeveling 450 mg/dag is. De aanbeveling is gebaseerd op een optimaal effect op hartritme, maar er zijn goede aanwijzingen dat een hogere inname extra gunstige effecten met zich mee kan brengen vanwege de antitrombotische eigenschappen en het vermogen om de bloeddruk, hartfrequentie en het triglyceridegehalte te doen dalen. Wij berekenden dat onze paleolithische voorouders, die leefden in het land-waterecosysteem, een dagelijkse EPA/DHA-inname hadden die in de grootteorde van gram lag.31
Naast het bovengenoemde voorbeeld van de visolievetzuren zijn er vele andere factoren in onze huidige westerse leefstijl die leiden tot een chronische toestand van systemische lagegraadontsteking die op zijn beurt aanleiding geeft tot een chronische vermindering van de insulinegevoeligheid, compensatoire hyperinsulinemie en uiteindelijk de ziekten die hieraan zijn gerelateerd. We hebben te maken met een chronische disbalans tussen pro- en anti-inflammatoire factoren die netto leidt tot een overheersing van de pro-inflammatoire staat, en de daaruit voorkomende aanpassingen van ons metabolisme (zie boven). De leefstijlfactoren die hierbij een rol spelen, kunnen worden onderverdeeld in een onevenwichtige samenstelling van onze voeding (een chronische vorm van lichte ‘wanvoeding’) en niet-voedingsgerelateerde factoren, die deels hun invloed uitoefenen via obesitas.32-34 Tot de inflammatoire factoren in onze huidige voeding behoren o.a.: de consumptie van verzadigde vetzuren en industriële transvetzuren, de ‘endotoxemie’ van een hoogvet-, laagvezelvoeding, een hoge ω6/ω3-vetzuurratio, een lage visolievetzuurinname (zie boven), een lage status van vitamine D, vitamine K en magnesium, een disbalans tussen de vele micronutriënten die deel uitmaken van ons anti-oxidant/pro-oxidantnetwerk, de consumptie van koolhydraten met een hoge glycemische index en een te lage inname van groenten en fruit. Indirect aan voeding gerelateerde factoren zijn een abnormale samenstelling van de bacteriële flora in mond en darm, en peridontitis. Voorts zijn betrokken stress, (passief) roken en milieuverontreiniging, onvoldoende fysieke activiteit en slaaptekort.32-24
Wetenschappelijke paradigma’s
Elk van de bovengenoemde leefstijlfactoren heeft te maken met een andere. Ze zijn causaal met elkaar verbonden of vertonen interactie. Het is nagenoeg onmogelijk, laat staan zinnig, om elk van deze factoren als een aparte entiteit te bestuderen. Zo bestaat onze voeding uit miljoenen stoffen die een biologisch verband met elkaar vormen. Het is ondoenlijk om de gezondheidsaspecten van al deze stoffen in hun verschillende doseringen en al hun interacties met andere stoffen te bestuderen door gebruik te maken van het huidige paradigma van randomized controlled trials (RCTs).35 Toch is dat hetgeen in de huidige voedingswetenschappen op grote schaal wordt gedaan, en een RCT-opzet is voor vele high impact tijdschriften een belangrijk criterium om acceptatie voor publicatie te overwegen.
We eten echter geen enkelvoudige componenten zoals magnesium of complexere systemen zoals visolie, maar ‘biologische systemen’, zoals een banaan, sperziebonen of een stuk vis. In die systemen bestaat een functioneel verband tussen de samenstellende nutriënten. Er is sprake van de balansen en interacties die horen bij een levend organisme: onze voeding ‘leeft’.
Andere voorbeelden zijn de relaties en interacties tussen slaaptekort en obesitas,36 onze voedingssamenstelling en de hierdoor geselecteerde bacteriële flora in onze darm,37 de consumptie van verzadigde vetzuren en koolhydraten(38) etcetera etcetera. Met onze huidige manier van reductionistisch denken dat zijn beslag krijgt in het verrichten van RCT’s met de aparte leefstijlfactoren en nutriënten komen we er nimmer uit. Sterker nog: de uitkomsten hiervan, samengevat in elkaar soms tegensprekende meta-analyses die niet zelden zijn gebaseerd op dezelfde RCT’s, zetten ons regelmatig op het verkeerde been. Niet vaak worden we hierbij herinnerd aan het feit dat ‘geen bewijs van effect’ niet een synoniem is van ‘bewijs van geen effect’, noch dat een ‘bewezen effect’ geen synoniem is van ‘relevantie’.
Terug naar het verleden
Onze evolutionair tot stand gekomen balans (homeostase) kan worden gevonden in de reconstructie van onze paleolithische leefstijl.39,40 Hierbij zijn vele disciplines betrokken, zoals de archeologie, evolutieleer, antropologie, biogeochemie, biologie, epidemiologie, genetica, geologie, (vergelijkende) anatomie en (patho)fysiologie.41 De gereconstrueerde gegevens kunnen worden gebruikt om via wetenschappelijk onderzoek onze balans met de natuur te herstellen naar de cultuur van de 21e eeuw. Genetisch zijn we sinds de paleolithische tijd (2,5 miljoen tot 10.000 jaar geleden) nagenoeg niet veranderd(42) en geen weldenkend mens overweegt om onze genen via modificatie aan te passen op hoe we momenteel leven. Terug naar de paleolithische tijd moeten we uiteraard niet letterlijk opgevatten: niemand hoeft terug achter de wilde zwijnen aan te hollen of naar knollen te graven. Evenzo wordt hier niet bedoeld om als pseudogrotbewoner rauw vlees te eten en in de winter op blote voeten en met ontbloot bovenlijf door New York’s Central Park te rennen, zoals sommige voedingswetenschappers als ‘tegenargument’ aanvoeren.
Zo vertonen, als voorbeeld, de botten van onze paleolithische voorouders de sporen van hun hoge fysieke activiteit.43 In beide seksen was er sprake van het verlies van bot, maar er waren geen osteoporotische fracturen. Evenzo zijn er geen aanwijzingen voor het verlies van botmassa met de daarbij behorende toename van de fragiliteit, zoals we die tegenwoordig waarnemen bij de postmenopausale en seniele osteoporose.44 Primaten in het wild en traditioneel levende bevolkingsgroepen die in de Oost-Afrikaanse wieg van de Homo sapiens wonen, hebben een zeer hoge vitamine D-status zonder sporen van de door velen gevreesde vitamine D-toxiciteit (Luxwolda, Br J Nutr, in press). Herstel van de botbalans van vroeger vraagt dan ook niet om een enkele magic bullet. De gegevens uit epidemiologisch onderzoek en case-control-, prospectieve- en interventiestudies laten zien dat het gaat om meer bewegen, maar ook over de blootstelling aan zonlicht, de vitamine K2-status, en talrijke voedingsfactoren zoals de consumptie van vis, het herstel van het zuur-base-evenwicht door de voldoende consumptie van groenten en fruit, de inname van fytaat uit granen en de inname van natrium, magnesium en calcium. Evenzo gaat het niet alleen over de hoeveelheid calcium in de voeding en de efficiëntie van de opname, maar ook dat het opgenomen calcium in het lichaam op de juiste plaats wordt vastgehouden en dat bij voorkeur gedurende ons gehele leven (Luxwolda, Br J Nutr, in press).
Er zijn reeds diverse pogingen gedaan om de voeding in de paleolithische tijd te reconstrueren.31,45 De resultaten van de eerste interventiestudies met deze voeding zijn ronduit positief. Bijvoorbeeld, in een weliswaar ongecontroleerde studie met niet-obese sedentaire gezonde proefpersonen had een eucalorische paleolitische voeding reeds in 10 dagen een gunstig effect op drie van de vier symptomen van het metabool syndroom: bloeddruk, plasmalipiden en glucosehomeostase. Het vierde symptoom, i.e. overgewicht/obesitas, werd in deze studie niet veranderd om te voorkómen dat de eventueel gunstige veranderingen zouden worden toegeschreven aan het gewichtsverlies.46 Met ons huidige eenzijdige interpretatie van evidence-based medicine(47,48) is deze proof of principle al snel verworpen met argumenten zoals: te klein, niet gecontroleerd, geen harde eindpunten en geen actieve component (lees: magic bullet) geïdentificeerd. We vergeten daarbij dat 85 % van de huidige medische handelingen niet gebaseerd is op solide klinische trials, waaronder de suppletie van patiënten met pernicieuze anemie met vitamine B12,49 dat er ook geen evidence is voor evidence-based medicine, en dat er maar één paradigma is in de wetenschap, namelijk ‘aanvaard nooit een paradigma’.
Epiloog en conclusies
De boodschap uit de evolutionaire geneeskunde is duidelijk. Cultureel zijn we mensen uit de 21e eeuw maar ons genetisch materiaal bevindt zich nog in de paleolithische tijd.39-40 We hebben onze leefstijl in een te korte tijd veranderd om ons daarop genetisch te hebben kunnen aanpassen. Diegenen die genetisch het meest gevoelig waren, zijn bij deze veranderingen het eerst ziek geworden. De secundaire betrokkenheid van ons genoom leidt de aandacht af van de omgeving als de primaire oorzakelijke factor in de daling van het aantal jaren dat we vooral na de reproductieve tijd leven zonder chronische ziektes. Paracelsus (1493-1541) heeft onze geleerd dat ‘het de dosis is die het gif maakt’, hetgeen met onze huidige kennis betekent dat bij voortgaande verandering van onze omgeving uiteindelijk zelfs het meest resistente allel een disease susceptibility gene wordt.
Onze huidige leefstijl wordt gekenmerkt door een disbalans tussen pro- en anti-inflammatoire factoren, die een chronisch systemische lagegraadontsteking veroorzaakt en ons metabolisme doet aanpassen via evolutionair geconserveerde overlevingsmechanismen. Die aanpassing geschiedt o.a. via het ontstaan van insulineresistentie, en leidt op lange termijn tot het metabool/insulineresistentiesyndroom en de hierbij behorende typisch westerse ziekten. Hierop is in de evolutie niet geselecteerd, waarschijnlijk omdat een levenslange pro-inflammatoire toestand in het verleden niet voorkwam. Eén van de (volstrek normale) metabole veranderingen bij een ontsteking betreft ‘de cholesterol’ en daarop hebben we ons decennia lang blindgestaard. Dat is begonnen in de jaren vijftig toen Ancel Keys de eerste gegevens publiceerde uit de Zevenlandenstudie die aangaven dat het serumcholesterol een lineaire associatie vertoont met hart- en vaatziekte. Nu we weten dat deze associatie secundair is aan systemische lagegraadinflammatie, wordt het tijd om ten behoeve van preventie de kraan dicht te draaien (Volksgezondheid) en daarbij, indien nodig, ook te blijven dweilen (Gezondheidszorg).
Voor het dichtdraaien van die kraan moeten we teruggaan naar de leefomstandigheden van de tijd waarin we genetisch zijn geworden tot wat we nu voor het overgrote deel nog steeds zijn. Het huidige paradigma van evidence-based medicine, of beter datgene dat het is geworden, zit ons daarbij vaak in de weg. Evidence-based medicine is uitgevonden voor medische handelingen en voldoet met beperkingen vooral voor bv. geneesmiddelenonderzoek. Via een RCT kan alleen worden bewezen dat het niet eten van groente en fruit ongezond is en dat is onethisch. In de voedingswetenschappen kan beter gebruik gemaakt worden van de ‘Hillcriteria voor causaliteit in een biologisch systeem’,50-51 welke in essentie reeds waren gepostuleerd door de Nobelprijswinnaar Robert Koch (1843-1910). Voor het maken van voedingsaanbevelingen is het van belang om het ‘voorbehoudprincipe’52 te vervangen door risk-benefitanalysen.53-55
Vanwege de huidige manier waarop evidence-based medicine wordt gepraktiseerd in de voedingswetenschappen dreigt een kloof te ontstaan tussen hetgeen gezondheidsraden goed voor ons achten en wat het publiek te horen krijgt via wetenschappers die zich niet op dogmatische wijze wensen te conformeren aan de artificiële hiërarchie in de bewijskracht die is toegekend aan de verschillende studieontwerpen.48 Via deze wetenschappers heeft Oprah Winfrey meer invloed op de dosering van het vitamine D-supplement dat het Amerikaanse publiek neemt dan het respectabele Institute of Medicine (IOM). Andere voorbeelden van huidige controverses zijn de (snelle) koolhydraten, hoogeiwitvoedingen, jodium en de recente commotie over een meta-analyse die laat zien dat er geen wetenschappelijk bewijs is voor de risico’s van het gebruik van teveel zout.56-57
Door een paleolithische leefstijl na te bootsen zal niet zozeer onze levensverwachting stijgen, maar mag worden verwacht dat het aantal jaren dat we zonder chronische ziektes leven toeneemt. Dat betekent gezondheidswinst voor het betrokken individu, maar is vanwege het preventieve aspect waarschijnlijk ook de enige effectieve manier waarop de kosten in de Gezondheidszorg op termijn kunnen worden beperkt. Alleen door te leren van ons verre verleden geven we er blijk van dat we de lessen van Darwin ook daadwerkelijk hebben begrepen.